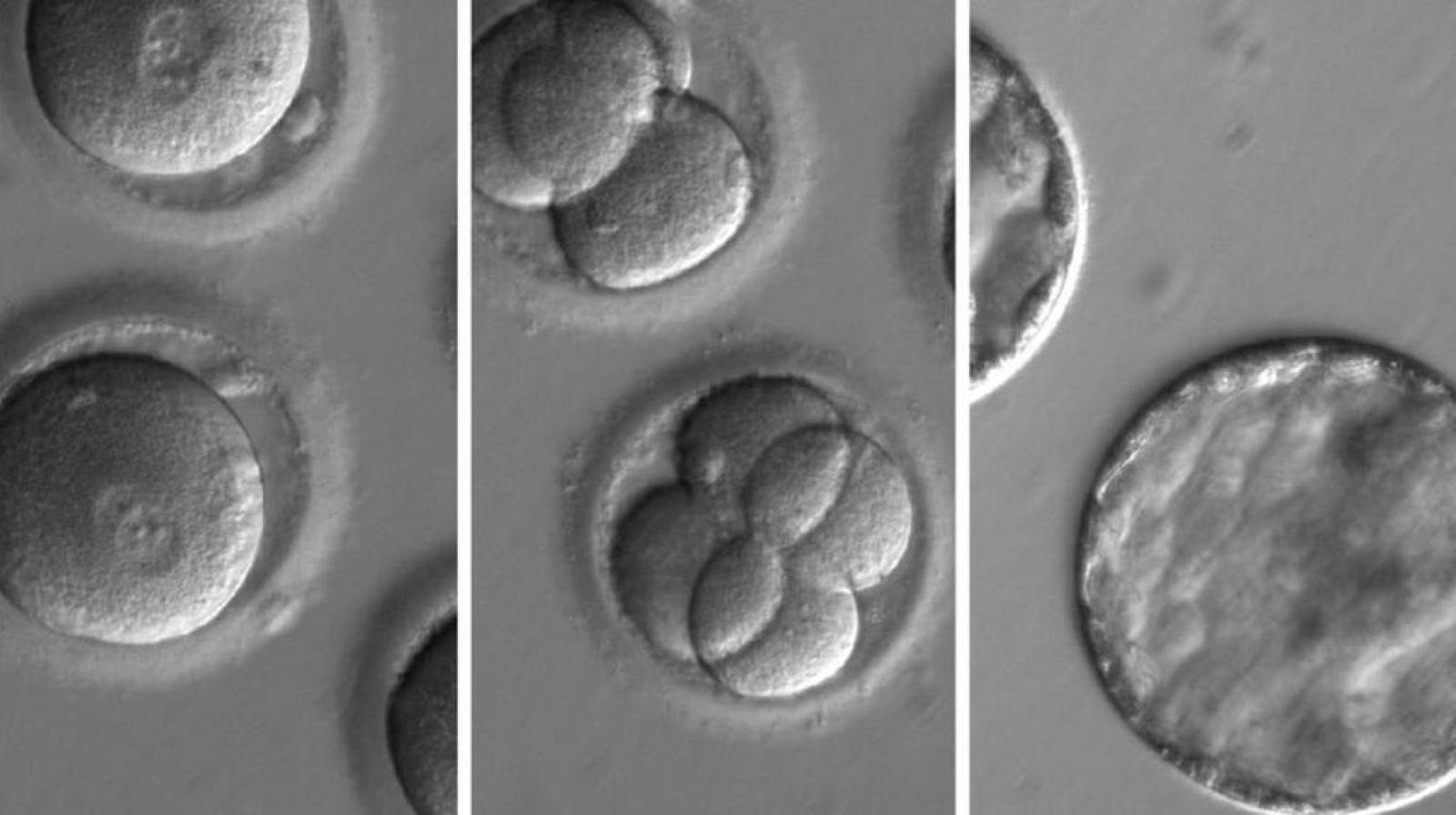
Immagini rappresentative (da destra verso sinistra) di zigoti in cui è stata iniettata la proteina Cas9 legata all'RNA guida, embrioni contenenti ciascuno otto cellule, blastocisti. Le immagini sono tratte dall'articolo Correction of a pathogenic gene mutation in human embryos pubblicato su Nature il 3 agosto 2017.
L’editing genetico, a quanto pare, ha funzionato. In 42 embrioni umani su 58, grazie alla tecnica CRISPR/Cas9, il DNA è stato riscritto nel punto giusto e la mutazione responsabile della cardiomiopatia ipertrofica, una malattia del cuore, è stata corretta. L’annuncio è stato dato lo scorso giovedì 3 agosto su Nature da un gruppo di genetisti americani e ha fatto, immediatamente, il giro del mondo. Sgombriamo subito il campo da ogni equivoco. Per quanto promettente, si tratta di un esperimento del tutto preliminare. E non sappiamo né se né tantomeno quando potrà essere utilizzato in fase clinica. Occorrerà ripeterlo. Assicurarsi che tutto sia andato davvero bene. E, anche, diminuire quella percentuale, piccola ma non nulla (27,6%), di insuccessi. C’è ancora molto tempo prima che la terapia genica esperita con la tecnica CRISPR/Cas9 diventi tecnicamente utilizzabile. Utilizziamolo bene, però, questo tempo. Perché, per quanto lungo, quasi certamente non sarà infinito.
Le promesse
L’editing genetico sta dimostrando sul campo tutte le sue potenzialità. Tuttavia ci sono alcuni problemi che devono essere dibattuti e risolti. E poiché si tratta non di problemi scientifici, ma etici e sociali, la discussione deve essere vasta, trasparente, serena e aperta a tutti noi, cittadini non esperti. I problemi che l’esperimento di Hong Ma e colleghi rende attuali sono almeno tre. Il primo riguarda la terapia genica applicata alla linea germinale per prevenire malattie gravissime. A questo punto ci sono due interessi legittimi in potenziale conflitto. Da un lato, l’interesse dei nascituri a venire al mondo sani. La CRISPR/Cas9 potrebbe consentire, in un futuro speriamo prossimo, di prevenire qualcosa come 10.000 diverse malattie genetiche monofattoriali (causate da mutazioni su un singolo gene), ma anche abbassare la probabilità di contrarre malattie di origine genetica polifattoriali (causate sia dalla combinazione di diversi geni mutati sia da un singolo gene mutato che si esprime solo in particolari condizioni ambientali). In buona sostanza, si tratta, potenzialmente, di offrire una vita sana a milioni di persone che nasceranno in un prossimo futuro.
I problemi
Ma, in parziale conflitto con questa opportunità, c’è l’interesse – il diritto – delle future generazioni di non essere vittime di un nostro errore. Intervenire sulla linea germinale di un individuo significa infatti “riscrivere” il DNA di tutta la sua prole a venire. Se si commette oggi un errore, questo errore è per sempre non solo per l’individuo, ma per i suoi figli e per i figli dei suoi figli. Occorre trovare il modo migliore per tutelare entrambi gli interessi: da un lato quello di milioni di persone cui verrebbe evitata una vita da malato e spesso anche la morte; dall’altro quelle delle generazioni future a non ereditare i nostri eventuali errori, per quanto commessi a fin di bene.
Un secondo problema del tutto generale legato all’annuncio di giovedì scorso, riguarda la tecnica in sé: la CRISPR/Cas9. Ha dimostrato di essere efficace e precisa. Sappiamo, anche, che è facile da applicare ed economica. In breve tutti i laboratori di biologia potrebbero imparare a utilizzarla. Autorizzati e non. Benintenzionati e non. Il problema che si pone, dunque, è: come far sì che la CRISPR/Cas9 venga utilizzata solo da laboratori autorizzati e per obiettivi generalmente considerati desiderabili? E come impedire, di converso, che venga utilizzata per obiettivi poco desiderabili se non pericolosi?
Le cronache di questi ultimi anni hanno dimostrato che, come è sempre avvenuto in passato, questa tecnica innovativa non può (aggiungeremmo, non deve) essere disinventata. Dobbiamo imparare a gestirla. E nessuno ha una facile ricetta. Men che meno coloro che vorrebbero mettere la mordacchia alla scienza. I biologi e i medici devono essere liberi di continuare le loro ricerche anche con l’editing genetico. Perché c’è tanto da imparare. Lo abbiamo visto proprio con questo esperimento. L’allele che causa la cardiomiopatia ipertrofica è dominante. Il che significa che le persone che si ammalano (a meno di non avere ereditato l’allele sbagliato da entrambi i genitori) hanno un allele sano, ma recessivo. Ebbene, quando l’allele mutante è stato corretto con CRISPR/Cas9 ha perso la sua dominanza. E si è attivato l’altro allele, sano dal principio, per così dire. Non si sa perché. E, dunque, c’è ancora molto da studiare.
Una terapia per tutti?
Un terzo ordine di problemi riguarda l’accesso a una futura eventuale terapia genica. Non deve diventare una terapia a disposizione solo di pochi, ma deve diventare una terapia per tutti (beninteso, se decideremo di utilizzarla). E, dunque, dobbiamo rimuovere dall’inizio ogni fattore di discriminazione all’accesso in base al reddito, alla nazionalità, al genere.
Tutti questi problemi non sono nuovi. Ma sono riproposti con forza dall’esperimento di Hong Ma e colleghi, date le caratteristiche di precisione, facilità ed economicità della tecnica CRISPR/Cas9. Abbiamo tutto il tempo e, come abbiamo detto, lo dobbiamo utilizzare al meglio. Con un dibattito profondo, sistematico, ben argomentato e sereno che coinvolga tutti i cittadini italiani, europei e del mondo. Questa discussione deve iniziare subito. E gli uomini di scienza hanno due sole responsabilità aggiuntive rispetto a quelle di noi cittadini non esperti: dirci, di volta in volta, “dove la scarpa fa male”; essere i promotori di questa discussione, perché nessuno più di loro conosce l’attualità, le potenzialità e anche gli eventuali rischi associati all’uso di questa nuova tecnica.


