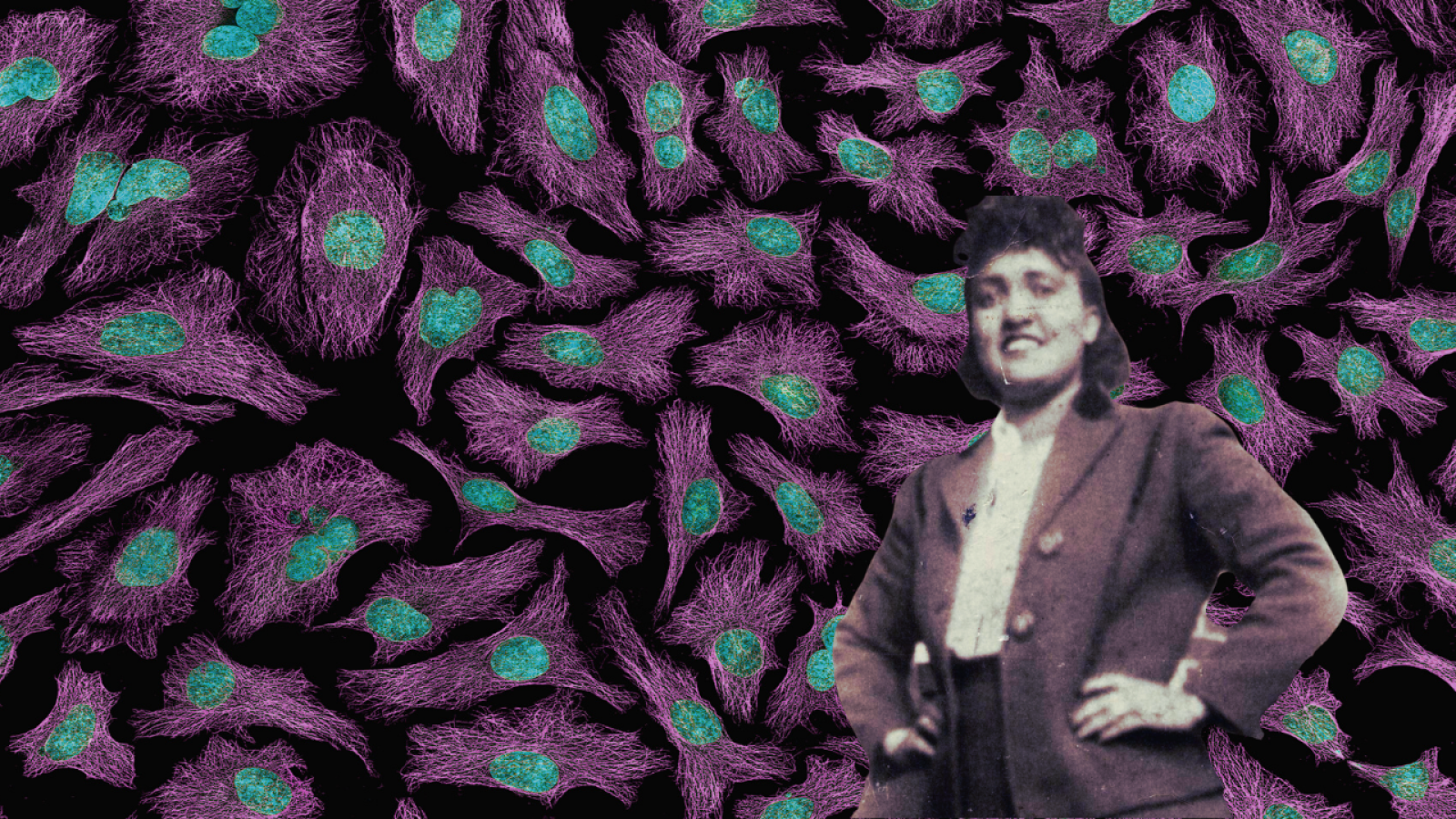
In primo piano, una delle poche foto di Henrietta Lacks arrivate fino a noi (Wikipedia, Lacks Family, via The Henrietta Lacks Foundation) e sullo sfondo un'immagine di microscopia a fluorescenza delle cellule HeLa (National Institute of Health via Wikimedia Commons).
Immaginiamo di essere in un qualsiasi istituto di ricerca, per la precisione in un laboratorio di biologia cellulare. Qui si studiano cellule di ogni tipo: i ricercatori se ne prendono cura tutti i giorni, le sottopongono a un’infinità di trattamenti diversi – somministrazione di sostanze tossiche, farmaci sperimentali, infezioni da parte dei virus più disparati – le osservano attentamente, conducono esperimenti. Ciò è possibile soprattutto grazie alle linee cellulari, ovvero le colture di cellule – umane o animali – in grado di riprodursi in vitro indefinitamente e potenzialmente immortali. Le linee cellulari hanno nomi ostici, spesso nient’altro che sigle che trovano posto negli articoli scientifici e su provette e piastre conservate nei laboratori: Hek293, Kbm-7, Hap-1 sono solo degli esempi.
Tra queste, le più diffuse sono le HeLa, una linea di cellule tumorali della cervice uterina, estremamente resistenti e in grado di moltiplicarsi in maniera indefinita in numerosissime condizioni. HeLa però non è una sigla come un’altra: dietro quelle due sillabe si cela il nome di una donna afroamericana originaria della Virginia, che nel 1951 è morta a causa di un tumore al collo dell’utero nell’ospedale Johns Hopkins di Baltimora, nel Maryland. Le sue cellule cancerose, prelevate senza il suo consenso - non che fosse necessario, all’epoca - sono state la prima linea cellulare della storia. Nel corso degli anni, le cellule HeLa si sono diffuse in maniera capillare nei laboratori di tutto il mondo, e hanno fatto sì che venisse implementato il vaccino contro la poliomelite, hanno favorito gli studi sui tumori di ogni tipo, le ricerche sull’AIDS e sull’infezione da HIV, fino a essere protagoniste di esperimenti sugli effetti dell’assenza di gravità.
Fino a qualche decennio fa, in pochi conoscevano da dove venissero le cellule HeLa: la sua storia e quella della sua famiglia oggi è nota grazie soprattutto a un libro scritto dalla giornalista scientifica Rebecca Skloot dal titolo La vita immortale di Henrietta Lacks, pubblicato nel 2010, quasi sessant’anni dopo la morte della donna. Da quel momento, c’è stato un crescendo di riconoscimenti da parte di istituzioni pubbliche e dalla comunità scientifica: risale al 13 ottobre scorso la notizia che l’Organizzazione Mondiale della Sanità ha riconosciuto il contributo nelle scienze biomediche di Henrietta Lacks. La vicenda della donna è densa di controversie, che faticano a risolversi nonostante il tempo trascorso: di qualche settimana fa è la notizia che gli eredi di Lacks hanno intentato una causa contro l’azienda biotech Thermo Fisher Scientific, sostenendo che l’azienda abbia continuato a riprodurre e vendere le cellule HeLa senza chiedere o assicurarsi il consenso della sua famiglia, in un “un sistema medico razzialmente ingiusto".
La breve vita di Henrietta Lacks
Ma facciamo un passo indietro fino al gennaio del 1951, a Baltimora, quando Mrs. Lacks, una giovane donna sposata e con cinque figli, si presenta alla clinica di ginecologia riservata ai pazienti colored (è l’America della segregazione razziale, e pochi ospedali offrono gli stessi standard clinici per bianchi e neri) del Johns Hopkins Hospital perché da qualche mese ha cicli mestruali irregolari, dolori diffusi nella zona pelvica e percepisce un corpo estraneo all’altezza del suo utero. Henrietta è figlia di coltivatori di tabacco della Virginia, è poco più che analfabeta e non è abituata a rivolgersi ai medici, ma tutti questi sintomi insinuano in lei l’idea che potrebbe avere qualcosa di grave. La visita ginecologica rivela una lesione - cancerosa, con tutte le probabilità - al collo dell’utero, e i medici decidono di eseguire una biopsia. In particolare, vengono prelevate quattro porzioni di tessuto della cervice uterina, di cui alcune vengono inviate al laboratorio di patologia per la diagnosi, che conferma le paure della donna: sulla cartella clinica di Lacks si legge che la lesione al collo dell’utero è un adenocarcinoma a cellule squamose della cervice uterina, una forma aggressiva di tumore maligno che, all’epoca, uccideva più di quindicimila donne americane ogni anno. Gli altri campioni, invece, vengono inviati al laboratorio di coltura tissutale del Johns Hopkins, diretto da George Gey. Prima della biopsia, a Lacks viene chiesto il consenso per l’intervento chirurgico, ma non viene menzionata la possibilità di raccogliere o condividere i suoi campioni per altri motivi. La donna viene immediatamente trattata con diversi cicli di radioterapia, che però non hanno i risultati sperati: Henrietta Lacks muore il 4 ottobre dello stesso anno, all'età di 31 anni, e viene seppellita a Clover, in Virginia, dietro la casa dove ha passato l’infanzia.
Coltivare il segreto dell’immortalità
La storia di Henrietta Lacks sembra finire qui, ma quella di HeLa è appena iniziata: mentre la giovane donna si sottopone alle terapie, infatti, nei laboratori di coltura cellulare del Johns Hopkins Mary Kubiceck, assistente di Gey, riceve il campione delle sue cellule cancerose. All’epoca Gey sta cercando di ottenere delle colture cellulari umane stabili in vitro, che derivino da un campione progenitore e che si riproducano indefinitamente, ma l’impresa sembra impossibile: qualsiasi sia il tessuto umano da cui provengono le cellule poste in coltura, esse, dopo un certo numero di replicazioni, muoiono. Inaspettatamente, però, questo non accade per le cellule di Henrietta Lacks: passano prima le settimane, poi i mesi, e le cellule, se adeguatamente curate, continuano a riprodursi senza sosta. Kubiceck appunta sulla prima capsula di Petri dove ha coltivato le cellule della donna le sue iniziali - come faceva per ogni campione proveniente da un paziente del Johns Hopkins - He e La: è stata scoperta la prima linea cellulare immortalizzata. Si tratta di un risultato insperato, e Gey inizia a parlare di HeLa alla comunità scientifica, inviando campioni di cellule ad altri laboratori sparsi per gli Stati Uniti d’America.
«Quando si parla della storia di Henrietta Lacks è importante contestualizzare: all'epoca non era ancora sviluppata un'attenzione verso il consenso dei pazienti» afferma Giovanni Boniolo, bioeticista e docente di filosofia della scienza e medical humanities all’Università di Ferrara. Concorda sull’importanza del contesto anche Marialuisa Lavitrano, docente di patologia all’Università di Milano Bicocca e direttrice di Bmmri Italy, infrastruttura di ricerca a cui partecipano biobanche e centri di risorse biologiche in tutta Italia. «La ricerca biomedica veniva condotta in maniera diversa da come viene condotta oggi, e soprattutto c'erano meno regole scritte che la governavano: ci si affidava al buon senso dei ricercatori e a una specie di codice di condotta. All'epoca chiedere il consenso di una paziente per fare un prelievo e fare delle ricerche non era obbligatorio. Sarebbe stato di buon senso farlo ma non era obbligatorio».
La vera consacrazione delle cellule HeLa, però, avviene nel 1953, quando la Fondazione nazionale per la paralisi infantile decide di installare al Tuskegee Institute, in Alabama, la prima fabbrica di colture cellulari all'avanguardia per coltivare e distribuire le cellule fondamentali per la valutazione del vaccino contro la poliomielite. Lo scopo della struttura è quello di coltivare in maniera standardizzata le cellule HeLa e poi spedirle agli istituti di ricerca pubblici di tutti gli Stati Uniti a prezzi calmierati. Qui la storia di HeLa si intreccia ancora una volta con la discriminazione, in particolare con una delle pagine più controverse della medicina contemporanea: Tuskegee infatti è tristemente famosa per gli esperimenti condotti dallo United States Public Health Service sugli effetti della sifilide in persone sane. Dal 1932 al 1972 vennero reclutati 400 mezzadri afroamericani malati di sifilide e furono osservati dai ricercatori per seguire l’evoluzione della malattia, ma senza essere curati con il trattamento disponibile all’epoca, la penicillina.
«Vi sono anche alcune situazioni ambientali a entrare nel merito di questa storia: Lacks era afroamericana e questo si collega a tutti quanti i problemi che vi sono stati in quel contesto, riassumibili in una poca considerazione dei pazienti di colore» sottolinea Boniolo. «Questo, insieme alla mancanza di consenso, sono i due aspetti più problematici dell’intera vicenda: adesso una cosa del genere non sarebbe assolutamente possibile».
Al culmine della produzione di quella che fu la prima cell factory in assoluto, potevano essere spedite circa 20.000 colture in provetta a settimana e nel giugno del 1955, il progetto HeLa di Tuskegee aveva spedito circa 600.000 culture. La fabbrica di colture cellulari viene dismessa pochi anni dopo, quando la Microbiological Associates Incorporated ha l’intuizione di potersi arricchire con queste cellule: prende il modello di successo progettato dalla Tuskegee University e lo utilizza per creare una fabbrica di colture cellulari su larga scala. Le cellule HeLa ben presto diventano le protagoniste degli esperimenti nei campi di ricerca più disparati. Tutto ciò, all’insaputa dei familiari di Henrietta Lacks, che vennero a conoscenza di quello che era capitato alle cellule della propria madre e moglie più di vent’anni dopo la sua morte.
Cosa si intende per consenso informato?
Le prime rimostranze che mossero i Lacks furono quelle di non aver firmato nulla riguardo il prelievo e l’utilizzo dei tessuti di Henrietta, ma solo di aver autorizzato l’autopsia. Quando salì agli onori della cronaca, negli anni Settanta del secolo scorso, il caso Lacks animò la comunità scientifica e l’opinione pubblica proprio perché in quegli anni si discuteva di consenso informato nelle pratiche mediche e di ricerca.
«Oggi, per essere valido, il consenso informato deve essere strutturato in un certo modo: prima di tutto esso possiede una prima parte che è informativa sulla pratica medica o di ricerca in oggetto, e poi c’è la richiesta di consenso vera e propria. In particolare, la parte informativa è cruciale, perché ai fini di un reale consenso informato è importante l’informazione stessa, il contesto in cui viene data, e l’intero processo comunicativo, oltre a quanto tempo si dà alla persona per comprendere davvero bene il tutto. Spesso oggi tutto ciò non avviene in maniera corretta: i tempi nei nostri ospedali e negli ambulatori per le procedure diagnostiche e terapeutiche sono veramente stretti a causa della carenza di personale, e questo costringe a non poter dedicare il tempo necessario alla comprensione della pratica clinica da parte del paziente» afferma Lavitrano.
«Il problema del consenso informato è che per essere veramente informato bisognerebbe che il paziente fosse a conoscenza di tutto ciò che avviene e che avesse anche la capacità di comprenderlo, nonché vi dovrebbe essere da parte del personale sanitario non solo un'attenzione nell'informarlo ma anche attenzione nel valutare se ha compreso che significa, il che comporta una quantità di tempo enorme che non è più possibile ritagliare. Alla fine è diventato quasi un atto burocratico buono per la medicina difensivistica» aggiunge Boniolo. Ma i problemi connessi all’odierno consenso informato non sono solamente comunicativi. «Il problema relativo alle cellule o altri tessuti conferiti per la ricerca è che questi possano avere un uso primario che è l'uso legato alla patologia connessa con quel particolare paziente e quel suo particolare organo, ma vi possono essere anche degli usi secondari. Quei tessuti possono essere immagazzinati nelle biobanche e poi utilizzati a scopo di ricerca magari dopo cinque, sei o dopo dieci anni, anche per scopi di ricerca che sono diversi da quelli legati alla patologia originaria. Il che significa che il paziente non può ovviamente essere informato su tali usi secondari e quindi la cessione delle sue cellule dovrebbe essere tutelata da un consenso di forma diversa dal canonico consenso 'informato'. Se ne dibatte da diversi anni a livello di bioetica internazionale», dice il bioeticista.
«Nel caso il paziente metta a disposizione i suoi tessuti e le sue cellule per la ricerca, quindi, il consenso informato deve essere il più accurato possibile» continua Lavitrano. «Il modulo di consenso deve essere strutturato in maniera corretta: deve contemplare la parte informativa, quella sulla privacy e deve contenere anche le motivazioni e il tipo di ricerca per la quale si dà il consenso. La menzione alla ricerca non può essere generica, ma deve essere identificata almeno la tipologia di ricerca: in Italia non è un consenso troppo ampio, ma è anche vero che nel momento in cui viene dato non si può prevedere anche quali possano essere altre ricerche future magari nello stesso contesto di ricerca, come per esempio il campo dell’oncologia. Comunque sia, nel caso si vogliano utilizzare quei campioni per un ambito di ricerca completamente diverso bisogna chiedere di nuovo il consenso al paziente».
Dall’eredità di Henrietta Lacks alle biobanche
Se negli anni Cinquanta la principale controversia relativa alla storia di Henrietta Lacks era quella del consenso informato e dell’eventuale guadagno da parte di chi commercializzava le HeLa, nessuno poteva immaginare che le più avanzate tecnologie della biologia molecolare avrebbero portato a un nuovo, enorme problema: quello della privacy. Quando il nome di Henrietta Lacks ha iniziato a diffondersi, prima tra la comunità scientifica e poi nel resto del mondo, si ignorava che da quel momento in poi sarebbe stato possibile collegare le informazioni genetiche che le cellule HeLa contenevano a quelle di una persona fisica, e dei suoi familiari e discendenti. Per esempio, nel 2013 un team di ricercatori ha pubblicato online l'intera sequenza del genoma di un ceppo di cellule HeLa. Non che la pubblicazione di dati genomici sia vietata da qualche legge: il problema è che in questo caso i dati fornivano alcune informazioni probabilistiche su una persona e sui suoi discendenti.
A distanza di più di sessant’anni dalla morte di Henrietta Lacks, le cellule HeLa erano ancora in grado di scatenare accesi dibattiti di bioetica, questa volta sull’utilizzo di campioni biologici da cui si possono generare dati sensibili come quelli genetici. In Europa attualmente l'utilizzo di campioni biologici per la ricerca è regolamentato a diversi livelli, di cui il primo è il General Data Protection Regulation (GDPR), il regolamento 679 del 2016 dell’Unione europea. Lavitrano ci spiega che «Il GDPR regolamenta la possibilità di fare ricerca, in particolare la ricerca biomedica che utilizza campioni biologici perché i campioni biologici sono di fatto generatori potenziali di dati. Dalla ricerca su un campione biologico, infatti, si estraggono dati, e poiché il campione rappresenta il soggetto indipendentemente se è sano o malato in quel particolare momento esso rappresenta dati sensibili».
«Oggi si cerca disperatamente di tutelare la privacy» aggiunge Boniolo, e una soluzione proposta dalla comunità scientifica è rendere i campioni totalmente anonimi. “Il problema è che con l’anonimizzazione non si riuscirebbero più a portare indietro le informazioni derivanti dalla ricerca al paziente o ai suoi familiari. Spesso quindi si ricorre a una procedura di pseudonimizzazione, dove il ricercatore non può risalire all’identità della persona che ha conferito il campione biologico, ma il paziente o la propria discendenza, qualora avessero deciso così, potrebbero saperlo. Inoltre, mai nessuna anonimizzazione è in realtà tale, perché da un punto di vista genetico le informazioni che identificano una persona, si ritrovano». Per questo negli ultimi decenni è emersa sempre di più la necessità di un garante di queste informazioni sensibili.
«Da qui l'importanza delle biobanche, che sono molto più che semplici repository di campioni biologici: esse possono fungere da soggetto terzo che offre delle garanzie sia sulla qualità dei campioni, ma anche nei confronti di chi li ha messi a disposizione, in modo che vengano utilizzati secondo le indicazioni espresse nel consenso. Inoltre, si possono restituire anche i risultati al soggetto se questo ha espresso questa volontà e così via, tenendo le fila tra le parti coinvolte» dice Lavitrano. «Insomma, le biobanche permettono di creare un legame positivo e protetto tra ricercatori, pazienti e società» conclude Boniolo. Una prospettiva totalmente diversa rispetto alla storia di Henrietta Lacks, nella quale si intreccia futuro della medicina e della ricerca, discriminazioni razziali, bioetica e privacy, e che probabilmente è destinata a rimanere immortale. Proprio come le sue cellule.


