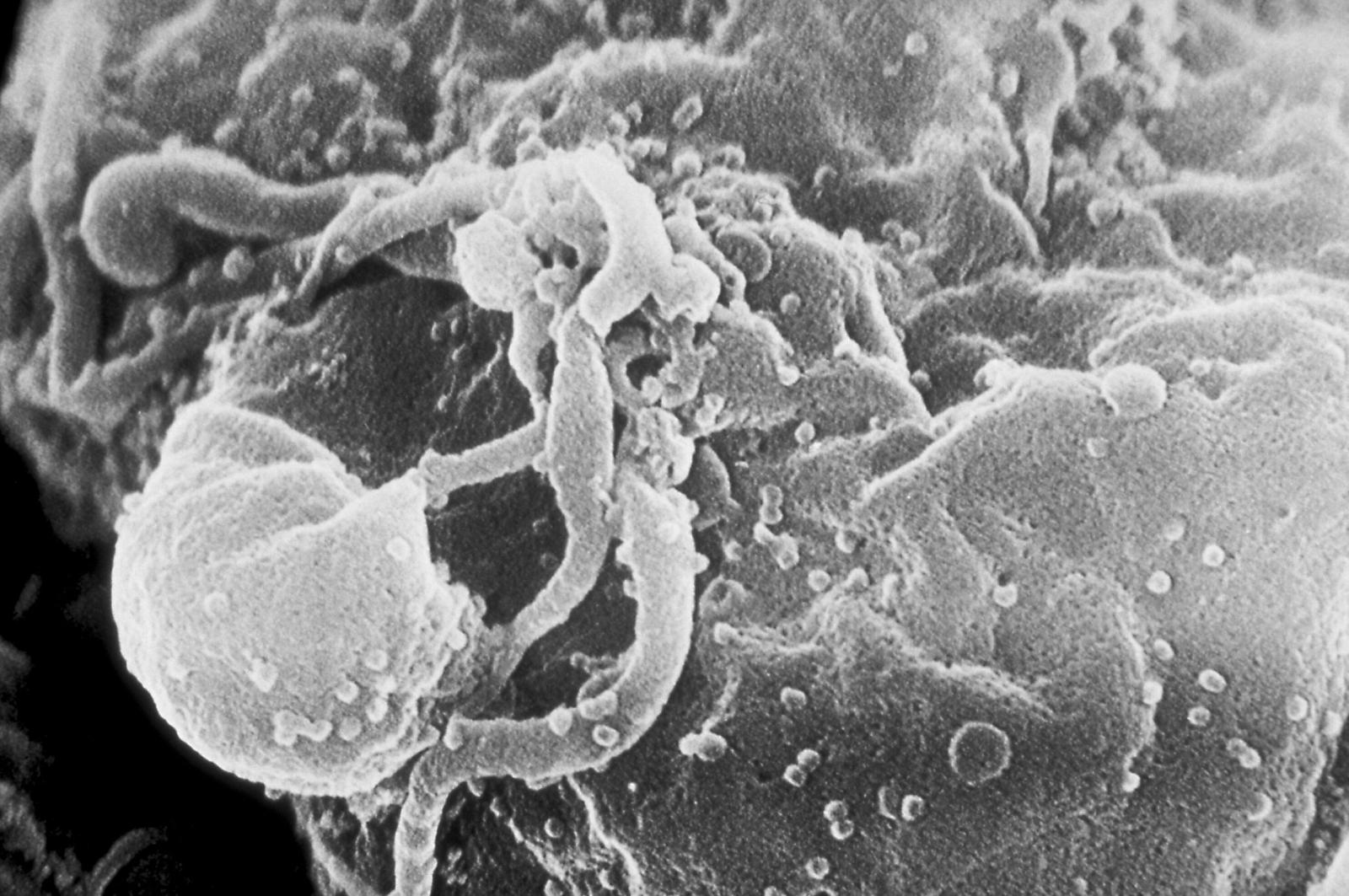
Una storia lunga quarant’anni: è quella ripercorsa ne La cura inaspettata (Mondadori, 2023) di Alessandro Aiuti e Annamaria Zaccheddu, dedicato ad HIV e a come da “peste del secolo” sia diventato (anche) un valido alleato della terapia genica.
Crediti: Wikimedia Commons. Licenza: pubblico dominio
In varie storie e film un nemico pericoloso finisce per rivelarsi, inaspettatamente, un prezioso alleato. A volte, questo capita anche nella realtà – perfino in quella biomedica.
È quanto successo con i virus, o almeno alcuni. Come l’HIV, per esempio: e proprio all’HIV è dedicato La cura inaspettata (Mondadori, 2023), il libro di Alessandro Aiuti, vice-direttore dell’Istituto San Raffaele-Telethon per la terapia genica di Milano e direttore dell’Unità Operativa di Immunoencologia pediatrica dell’IRCCS Ospedale San Raffaele. A firmare con lui queste pagine è Annamaria Zaccheddu, biotecnologa che lavora nella comunicazione scientifica di Fondazione Telethon.
Storie di famiglia
Questo è un libro che racconta della ricerca e delle sue sfide, ma è anche, almeno per certi aspetti, una storia di famiglia. Seguendo una logica linea temporale per “presentare” HIV, il virus responsabile dell’AIDS, infatti, la prima parte del saggio è dedicata agli albori dell’epidemia, dai primi casi segnalati negli Stati Uniti alla sua comparsa in Italia. Dove Fernando Aiuti, padre di Alessandro, è diventato uno degli esperti principali sulla malattia, seguendola in prima linea già dai primi casi segnalati, per poi contribuire non solo allo studio dell’AIDS ma anche alla lotta allo stigma che ha portato e purtroppo porta ancora con sé. È ancora famosa, infatti, la foto che lo immortala a dare un bacio a Rosaria Iardino, una donna sieropositiva, per dimostrare che la saliva non rischia di trasmettere il virus.
L’ansia della ricerca per individuare le cause dell’AIDS, fino all’identificazione del virus responsabile e prima del tutto sconosciuto; la sofferenza dei pazienti malati, compresi i bambini cui il virus era trasmesso per via materna; le difficoltà nel trovare una terapia efficace, che ha rappresentato una vera e propria sfida per il mondo biomedico (solo nel 1996 si è arrivati alla prima terapia anti-retrovirale, la cosiddetta HAART): sono tutti aspetti che il libro trasmette in modo chiaro, profondamente umano, anche grazie alle parole di chi vi è passato in prima persona. Si sente, insomma, il profondo coinvolgimento dell’autore, che ha seguito le orme paterne in più di un senso.
Alessandro Aiuti, infatti, non solo ha anch’egli portato avanti gli studi in medicina (sebbene, racconti, la passione per il lavoro di laboratorio gli avesse inizialmente fatto pensare di seguire gli studi in biologia), ma si è anche dedicato alle immunodeficienze. Se, però, l’immunodeficienza causata da HIV è del tipo detto “acquisito” (dal virus, appunto), le ricerche di Alessandro Aiuti si sono orientate invece alle immunodeficienze primitive, un vasto gruppo di malattie congenite che determinano una perdita di funzionalità, totale o parziale, del sistema immunitario. L’origine di queste malattie è genetica: ed è proprio qui che torna in campo HIV.
HIV, l’alleato inatteso
Aiuti e Zaccheddu seguono questo virus nel lungo percorso che ha compiuto nell’ambito della terapia genica. Il primo indizio del ruolo che HIV avrebbe potuto avere viene da un articolo apparso su Science nel 1996, proprio lo stesso anno che ha visto arrivare le prime valide terapie per contrastarne l’infezione. Lo studio, che vedeva come primo autore l’italiano Luigi Naldini, dimostrava che HIV poteva essere modificato ed essere così impiegato come vettore di geni, consentendo anche d’integrarli in modo stabile nel DNA. Questo lavoro, condotto su cellule umane e murine in cultura, rappresenta una pietra miliare della storia dei vettori virali nella terapia genica, e ha permesso l’ingresso ufficiale dei vettori lentivirali, derivati da HIV, tra i possibili candidati. È il primo passo di quello che Aiuti e Zaccheddu chiamano un “paradosso virale”: il nemico può diventare un alleato; il patogeno, un farmaco di precisione.
L’accoglienza all’idea di usare un virus temuto come HIV per la terapia genica, per inciso, non è stata inizialmente del tutto calorosa. Da una parte, «l’HIV e l’AIDS facevano ancora troppa paura» e, dall’altra, non era ancora chiaro, né scontato quanto applicabile fosse la pratica. Nonostante qualche battuta d’arresto, però, la terapia genica è riuscita ad arrivare in clinica. L’Italia, in questo senso, ha avuto un ruolo primario.
È di nuovo il 1996 quando viene costituito l’Istituto San Raffaele-Telethon per la terapia genica (SR-Tiget), che ha anche rappresentato il primo posto di lavoro per Aiuti. È qui che nasce la prima terapia genica basata su cellule staminali, approvata nel 2016, usata per il trattamento dell’ADA-SCID, un tipo d’immunodeficienza dovuta alla mancanza di un particolare enzima. Ed è qui che nasce anche quella per il trattamento della leucodistrofia metacromatica. Si tratta di una malattia metabolica dovuta all’assenza o al malfunzionamento di un enzima, a causa del quale l’organismo accumula sostanze dette sulfatidi in vari organi, soprattutto nel cervello: i sintomi si presentano nell’infanzia e peggiorano progressivamente fino a portare alla morte in giovane età. La terapia messa a punto all’SR-Tiget, approvata nel 2020, consente di inserire un vettore lentivirale, derivato da HIV, nelle cellule staminali del paziente: una volta reinfuse, le cellule sono in grado di raggiungere il cervello e replicarsi esprimendo il gene mutato – e, di conseguenza, consentendo la produzione del gene mancante o malfunzionante.
Sfide, anche etiche
Questi quarant’anni di storia di malattia, cura e ricerca hanno molti fronti e campi ancora da esplorare; per esempio, SR-Tiget sta tutt’ora portando avanti sperimentazioni per una terapia genica, basata su un vettore lentivirale, per il trattamento della sindrome di Wiskott-Aldrich, un’immunodeficienza primitiva legata a una mutazione sul cromosoma X (infatti interessa quasi esclusivamente i maschi).
Alle considerazioni sui risultati e le prossime frontiere della ricerca, comunque, La cura inaspettata affianca anche considerazioni di ordine etico che non possono essere ignorate. Per esempio, Aiuti e Zaccheddu riportano del rischio di ritiro dal mercato di Strimvelis, il farmaco usato per la terapia genica di ADA-SCID di cui abbiamo parlato poco fa, perché, come annunciato nel marzo 2022, l’azienda produttrice voleva concentrare le proprie attività su altre malattie. «La decisione di Orchard Therapeutics e, più in generale, lo scenario di disinvestimento dalla terapia genetica per le malattie genetiche rare in Europa ci ha molto demoralizzato», scrivono gli autori. «È innegabile però che per sviluppare e mantenere sul mercato farmaci così complessi, destinati a pochi pazienti all’anno, sia difficile sul lungo periodo». Le ragioni sono diverse, a partire da quelle di ordine economico.
Ma, continuano, «È inaccettabile che terapie in grado di cambiare la vita di bambini come quelli raccontati in queste pagine non siano disponibili soltanto per motivi economici. Tuttavia, il modello attuale di sviluppo è insostenibile e va ripensato».



