Immagine: US Patent No 11630516B1, Brain-machine interface (BMI) with user interface (UI) aware controller, figura 3, Neuralink Corp, 18 aprile 2023.
Dopo tante chiacchiere e un singolo post, Neuralink si è finalmente seduta al tavolo delle aziende che hanno impiantato un dispositivo di interfaccia cervello-computer nell’essere umano. Un commensale ingombrante di certo, ma Neuralink - l’azienda di neurotecnologia fondata nel 2016 da Elon Musk- è ancora lontana dall’occupare il capotavola. Nonostante l’attenzione mediatica infatti, l’impresa di Neuralink si inserisce in un crescente panorama di aziende e accademie dedite allo sviluppo di sistemi di comunicazione tra cervello e dispositivi elettronici, tanto che la rivista scientifica Nature aveva definito il 2023 “l’anno delle interfacce cervello-computer”. Ma se l’idea non è quindi così rivoluzionaria, cosa rende l’impianto di Neuralink diverso?
Cosa è un’interfaccia cervello-computer
Neuralink ha impiantato il suo primo prototipo di interfaccia cervello-computer (BCI- Brain Computer Interface), ovvero un dispositivo capace di registrare l’attività di gruppi di neuroni, decodificarla e tradurla in un segnale a sua volta in grado di controllare un dispositivo esterno.
Questo tipo di strumenti sono spesso composti da un sensore che capta l’attivazione dei neuroni, un amplificatore che migliora la qualità del segnale e un processore che lo analizza (spesso implementato con algoritmi di intelligenza artificiale). Quest’ultimo, estraendo le caratteristiche principali del segnale, lo categorizza e lo traduce in un linguaggio comprensibile ai dispositivi riceventi.
L’obiettivo è quello di creare un legame digitale, una via di comunicazione tra noi e le macchine. E gli approcci tecnologici per raggiungere il risultato sono diversi: si può tentare la via elettrica, come Neuralink e altri, che utilizzano come sensori degli elettrodi in grado di monitorare l’attività elettrica dei neuroni; o la via metabolica, impiegando sistemi come la risonanza magnetica funzionale (fMRI) o la spettroscopia funzionale del vicino infrarosso (fNIRS), che tracciano l’attività neuronale seguendo il consumo di ossigeno da parte dei neuroni in funzione. Ogni tecnica ha i suoi vantaggi e svantaggi, come la portabilità (provate a spostare l’enorme macchina per la risonanza magnetica funzionale) o la risoluzione spazio-temporale (un singolo elettrodo può misurare l’attività dei neuroni che gli sono vicini) e, forse su tutti, l’invasività.
Aprire o non aprire: il dilemma delle BCI
Le interfacce possono essere più o meno invasive, a seconda di quanto penetrano all’interno dei tessuti cerebrali. Basti pensare all’elettroencefalogramma (EEG): questo sistema di elettrodi posti sullo scalpo è una tecnica non invasiva e facilmente trasportabile per monitorare l’attività del cervello, spesso impiegata come sensore nello sviluppo di interfacce cervello-computer (il primo utilizzo risale agli anni 70). Il problema in questo caso sta nella precisione. Ad oggi grazie all’EEG siamo in grado di misurare diversi stati mentali, come le fasi del sonno o i livelli di concentrazione, e individuare alcuni disturbi, come i focolai epilettici o la demenza, ma le misurazioni rimangono largamente complessive e rumorose, ovvero sono in grado registrare solo oscillazioni elettriche robuste e di zone molto ampie e superficiali. «Se ti trovi fuori da una sala da concerto, sentirai una versione molto distorta di ciò che sta suonando all'interno: questo è uno dei problemi delle BCI non invasive», spiega Ana Matran-Fernandez, ricercatrice nel settore dell'intelligenza artificiale presso l'Università dell'Essex, alla rivista Wired. «Avrai un'idea del tempo generale, del pezzo che viene suonato, ma non puoi individuare in modo specifico ciascuno degli strumenti suonati. Questo è lo stesso con una BCI. Nella migliore delle ipotesi, sapremo quali aree del cervello sono i più attive - suonano più forte, se vuoi – ma non sapremo perché, e non sappiamo necessariamente cosa significhi per una persona specifica».
Ed qui che invece intervengono le tecniche più invasive: scendere sotto lo scalpo migliora di gran lunga la qualità del segnale, come dimostrano gli esperimenti con l’elettrocorticografia (EcoG), una elettroencefalografia intracranica, in cui gli elettrodi vengono posizionati subito sotto lo scalpo; ancora meglio poi se si penetra all’interno del tessuto e si inserisce l’elettrodo nello spazio intracellulare, proprio accanto al neurone di cui si vuole captare l’attività, come il dispositivo impiantato dalla compagnia di Musk, e non solo.
Decidere su cosa puntare dipende quindi dall’obiettivo. Compagnie interessate nello sviluppo di interfacce per l’intrattenimento (gaming o realtà virtuale) o indirizzate al pubblico generale, come la start-up CTRL-Labs acquisita da META nel 2019 o Neurable o Kernel e altre, stanno investendo nello sviluppo di interfacce non invasive, facilmente utilizzabili, che per ora però rimangono nel mondo non molto applicativo del monitoraggio degli stati mentali.
Un impatto più forte, ma meno scalabile, lo cercano le compagnie come Neuralink, che impiantando all’interno della corteccia, sono in grado di decifrare l’attività di determinate aree del cervello che codificano precise intenzioni - spesso di movimento - con il risultato di creare un legame preciso e facilmente manipolabile tra macchina e individuo. Il prezzo però, è una chirurgia a cranio aperto. È per questo che per ora gli unici individui per cui il rapporto costo-beneficio risulta accettabile sono pazienti che hanno perso la completa mobilità degli arti o del corpo intero, dovuta a lesioni della spina dorsale o malattie neurodegenerative come la Sclerosi Laterale Amiotrofica (SLA).
È dal 1998 che ci proviamo
Inserire elettrodi nel cervello di un essere umano è una pratica sdoganata - più o meno - ormai dal 1998, quando il gruppo di Philip Kennedy, della Emroy Univerisy ad Atalanta, ha inserito la prima interfaccia cervello-computer invasiva in un paziente locked-in, ovvero completamente immobilizzato a causa di un ictus. Già negli anni novanta quindi un soggetto era riuscito a muovere un cursore su uno schermo tramite la sola attività cerebrale. Da lì, la tecnologia è avanzata: nel 2004 Matt Nagle, un ragazzo rimasto tetraplegico a causa di una coltellata alla base del collo, ha ricevuto un impianto in grado di permettergli di controllare un braccio robotico. Nel 2012, gli esperimenti di movimento delle braccia robotiche si sono raffinati: gli studi del gruppo di Donoghue, parte del consorzio di scienziati della Brain Gate, hanno permesso a due donne, anche loro tetraplegiche, di muovere gli arti robotici con sette gradi di libertà.
Ma il movimento degli arti e il controllo di dispositivi elettronici sono solo due dei principali campi di applicazione; la decodifica e l’emissione del linguaggio sono sfide altrettanto dominanti: sono anni che le interfacce cervello-computer cercano di leggere gli intenti comunicativi di chi ha perso la possibilità di esprimersi, a causa per esempio di uno stadio avanzato di SLA. I risultati ci sono e si basano sulla decodifica dell’attività dei neuroni che controllano i movimenti oro-facciali; con il tempo, precisione e velocità di comunicazione stanno aumentando sempre di più.
La carta che ha veramente migliorato la nostra mano è stata l’introduzione dell’intelligenza artificiale. L’impiego di reti neurali e algoritmi predittivi di linguaggio naturale (gli stessi alla base di ChatGTP per intenderci) hanno segnato la svolta per le interfacce cervello-computer, che sono diventate molto più efficienti nel leggere e estrarre le informazioni neurali necessarie per dirigere le azioni di dispositivi in modo sempre più rapido e accurato.
Ma fino a poco tempo fa, c’era sempre un enorme, seppur sottile, problema: i fili. Tutti i dispositivi erano cablati, fattore di disturbo non indifferente se l’obiettivo è l’uso delle interfacce nella vita quotidiana dei pazienti. Già nel 2021 i ricercatori della Brain Gate hanno pubblicato i risultati del primo impianto wireless, senza fili, di un’interfaccia cervello-computer in due pazienti tetraplegici: i cavi erano stati sostituiti da un trasmettitore di cinque centimetri posto sulla testa dei soggetti, connesso a un sistema di elettrodi intercalati nella corteccia cerebrale, e le performance in termini di accuratezza e velocità dei comandi erano rimaste invariate rispetto alla controparte con i fili. Ma è nel 2023 che arrivano i risultati più interessanti.
2023: l’anno delle interfacce cervello-computer
La rivista scientifica Nature ha definito il 2023 come l’anno delle interfacce cervello computer e lo ha fatto a buon diritto.
A gennaio 2023 infatti sono usciti i primi risultati del trial clinico SWITCH, condotto dalla compagnia Synchron, che ha testato con successo in quattro pazienti australiani tetraplegici il proprio sistema di interfaccia: lo stentrode, una rete di 16 elettrodi simile a uno stent vascolare, inserita nel cervello attraverso una pratica poco invasiva (nessuna apertura del cranio). Spinto lungo la vena giugulare, lo stentrode arriva all’interno di un vaso sanguigno subito al di sopra della corteccia motoria, dove è in grado di adattarsi alla curvatura e alle dimensioni del vaso, aderendo alla parete vascolare, in modo da limitare gli effetti collaterali, come danni al tessuto e infiammazione. Da lì registra i segnali elettrici dei neuroni sottostanti, trasmettendoli - senza fili - a un controller esterno che comanda le azioni di dispositivi elettronici: cliccare, digitare, muovere un cursore, ma soprattutto farlo da casa per due anni. La stessa azienda ha iniziato il reclutamento e l’impianto in pazienti statunitensi nel luglio 2022, dopo l’approvazione dell’FDA, per il trial clinico COMMAND che seguirà i soggetti per due anni post impianto. Anche qui è una questioni di rischi e priorità: se lo stentrode della Synchron è di certo meno invasivo di un impianto a cranio aperto, il segnale che è in grado di captare non è altrettanto forte o pulito come quello registrato da elettrodi intracorticali, come quello che ha permesso a Gert-Jam Oskam di muovere le proprie gambe lo scorso maggio.
A maggio del 2023 infatti sono usciti i primi risultati dell’esperimento condotto dal gruppo di Guillaume Charvet, Jocelyne Bloch e Grégoire Courtine, in cui l’impianto di un EcoG (chiamato WIMAGINE, sviluppato dalla Clinatec), ovvero di un’elettroencefalogramma intracranico, ha permesso a un paziente paraplegico di controllare con il pensiero un dispositivo epidurale di stimolazione della spina dorsale, creando un ponte digitale wireless tra i neuroni nel cervello che controllano il movimento e i neuroni del midollo responsabili dell’attivazione dei muscoli delle gambe. L’esperimento, supportato anche da un fondo del Consiglio Europeo (progetto Reverse Paralysis), ha portato all’annuncio della ONWARD che, a settembre, ha dichiarato l’uso della stessa tecnica (ponte tra BCI e stimolatore della spina dorsale) in un sperimento mirato alla riacquisizione dell’utilizzo delle braccia.
Nel frattempo, ad agosto venivano pubblicati i risultati di due studi di “riacquisizione del linguaggio”, finalizzati al ripristino delle capacità comunicative di pazienti che hanno perso l’uso dei muscoli e delle articolazioni facciali a causa della SLA. In un approccio, sono stati utilizzati microelettrodi intracorticali, come quelli di Musk, per raccogliere i segnali nervosi che, con l'aiuto di una rete neurale e di un modello linguistico, sono stati decodificati a una velocità media di 62 parole al minuto, con un tasso di errore per parola del 23,8% per un vocabolario di 125.000 parole. Nell'altro approccio, è stata utilizzata un’elettrocorticografia (EcoG) come sensore e, ancora una volta, con l'aiuto di una rete neurale e di un modello linguistico, i pattern di attivazione dei neuroni sono stati decodificati a una velocità media di 78 parole al minuti, con un tasso di errore per parola del 25,5% per un vocabolario di 1.024 parole (in una conversazione naturale, il tasso di parole al minuto è in media di 160). Non male, peccato che qui ci siano ancora i fili.
Per quanto il 2023 si sia dimostrato un anno prolifico per le Brain Computer Interface, la Neuralink di Elonk Musk è dovuta rimanere in panchina, in attesa del permesso da parte dell’FDA di impiantare il proprio chip nell’essere umano. Ora però che è entrata in gara (perché è anche di questo che si tratta) cosa ci possiamo aspettare?
Il caso Neuralink
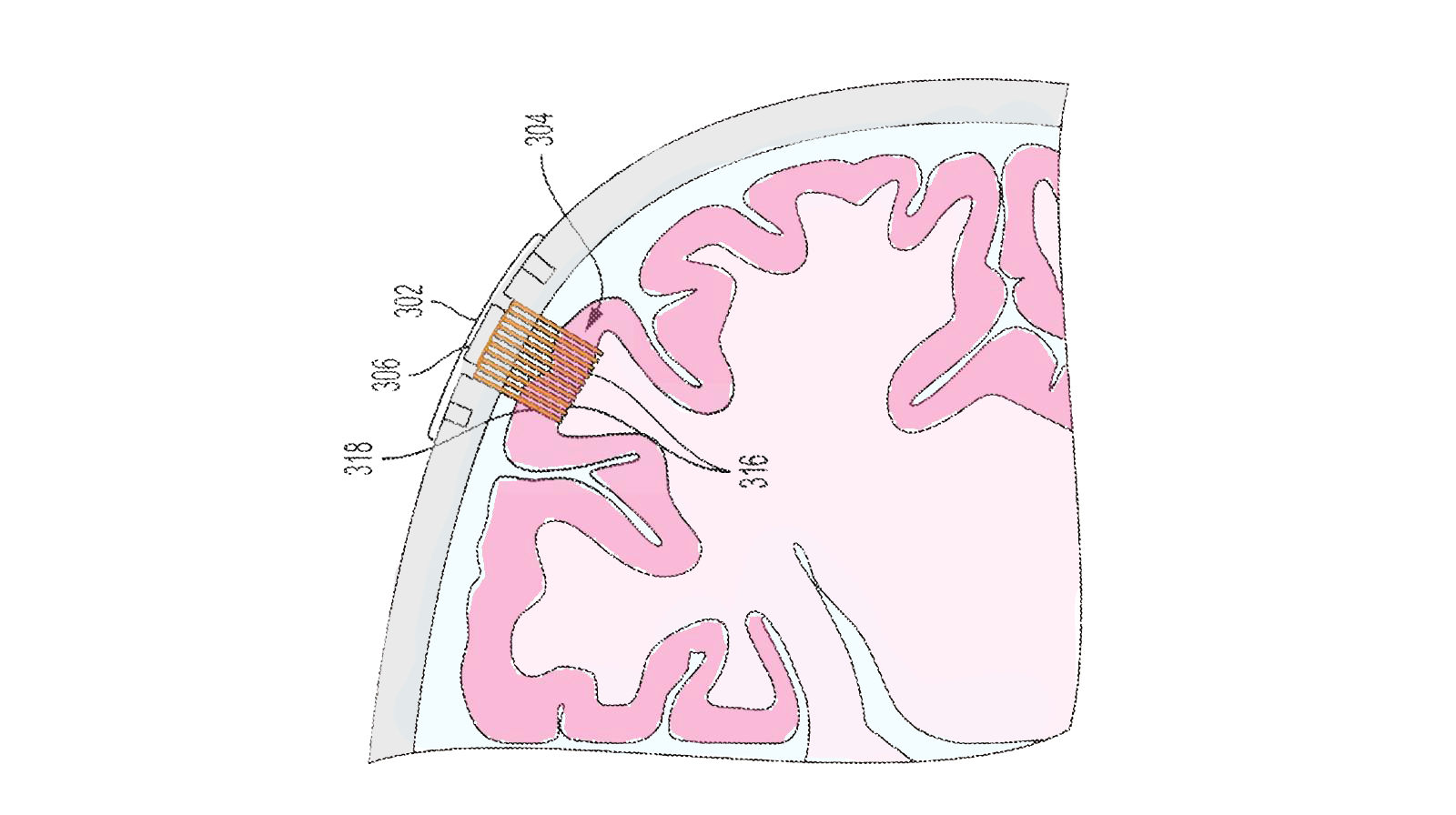
Il chip della Neuralink, recentemente impiantato in un essere umano, si chiama N1, telepathy per il grande pubblico, ed è un dispositivo composto da 64 fili sottili (1/10 di un capello) e flessibili che ospitano 1024 elettrodi in grado di misurare l’attività elettrica di almeno altrettanti singoli neuroni. La rivoluzione del dispositivo di Musk sta proprio nel numero di elettrodi e nella flessibilità del supporto, in grado probabilmente di inserirsi in corteccia limitando i danni al tessuto cerebrale e la naturale risposta cicatriziale, che con il tempo diminuisce il segnale captabile dagli elettrodi.
A oggi infatti, il dispositivo gold standard - se non l’unico - che registra l’attività di singoli neuroni impiantabile nell’essere umano è lo Utah array, sviluppato dalla compagnia Blackrock, e consiste in un centinaio di elettrodi montati su un supporto rigido, seppur piccolo. La versione wireless sviluppata nel 2021 poi rimane piuttosto visibile, poiché il minicomputer che decodifica i segnali e li trasmette senza cavi ha una dimensione di 5 cm di larghezza e 2 cm circa di profondità, contro i 24 mm di diametro e 8 mm di profondità dell’N1 di Musk. Più piccolo, più elettrodi, più morbidi: questi sono gli ingredienti speciali della Neuralink. Il problema è tutto il resto.
La comunità scientifica, infatti, esprime frustrazione: le informazioni mancano. Le uniche fonti sono la brochure di reclutamento dei candidati e i post di Musk sul social X. Non esattamente prove eccelse di trasparenza. Il trial (chiamato PRIME) inoltre non è registrato su ClinicalTrials.gov, un archivio pubblico online curato dal National Institutes of Health degli Stati Uniti, in cui i ricercatori registrano lo studio e il relativo protocollo prima di arruolare i partecipanti e la cui iscrizione è spesso condizione necessaria per la pubblicazione dei risultati su diverse riviste scientifiche. In quale regione del cervello hanno impiantato esattamente? Quali variabili misureranno? Sappiamo solo che lo studio coinvolgerà pazienti under 40 con tetraplegia e durerà sei anni. «Quello che spero di vedere è che possano dimostrare che è sicuro. E che è efficace nel misurare i segnali cerebrali – a breve termine, ma, soprattutto, a lungo termine», afferma su Nature Mariska Vansteensel, neuroscienziata presso il Centro medico universitario di Utrecht nei Paesi Bassi e presidente della società internazionale BCI.
La trasparenza quindi non è il forte di Neuralink, come il realismo non lo è di Elon Musk: a Novembre, quattro legislatori degli Stati Uniti hanno chiesto di verificare se il suo fondatore non avesse ingannato gli investitori di Neuralink, valutata 5 miliardi di dollari, omettendo informazioni sulla sicurezza dell’impianto. Ma mentre l’inchiesta parte, Musk rilancia: «Nel lungo termine, Neuralink spera di svolgere un ruolo nella riduzione del rischio per la civiltà dovuta all’intelligenza artificiale, migliorando la larghezza di banda» - ovvero la comunicazione - «da uomo a intelligenza artificiale (e da uomo a uomo) di diversi ordini di grandezza».
Lo scetticismo è garantito, il concetto invece è chiaro: per ora stiamo solo sfiorando le potenzialità delle interfacce cervello-computer, che si spera riescano a rispettare, nelle prossime decadi, la promessa di restituire, almeno in parte, un grado di indipendenza alle persone immobilizzate. Ma anche solo questo enorme traguardo è lontano e la commercializzazione dei dispositivi BCI è ancora nella sua fase infantile, neonatale quasi.
Se è vero che questi recenti sviluppi spingono a una riflessione sulle questioni etiche, come i neuro-diritti e la privacy mentale, è anche chiaro che stiamo parliamo solo di controllo motorio: i circuiti nervosi che regolano il movimento sono infatti piuttosto noti, semplici e scalabili, ovvero simili tra gli esseri umani. Tutto quello che è astratto, il pensiero, il dialogo interno e le emozioni, leggere la mente insomma è un fenomeno talmente individuale che rimane tutta un’altra storia, per ora.


